Caracteristicas Del Grupo 4a De La Tabla Periodica
Teluro Elemento químico de número atómico 52 masa atómica 12760 y símbolo Te.
Caracteristicas del grupo 4a de la tabla periodica. Antes de empezar a hablar de las características de los grupos de la tabla periódica tenemos que conocer en qué consiste este sistema. Recibe ahora mismo las respuestas que necesitas. 1 ABUNDANCIA EN LA NATURALEZA a Carbono.
2 La característica de este grupo es que tienen una configuración electrónica. Son por los siguientes elementos. Esto debido a que estas aleaciones son bastante fuertes y resistentes a la corrosión.
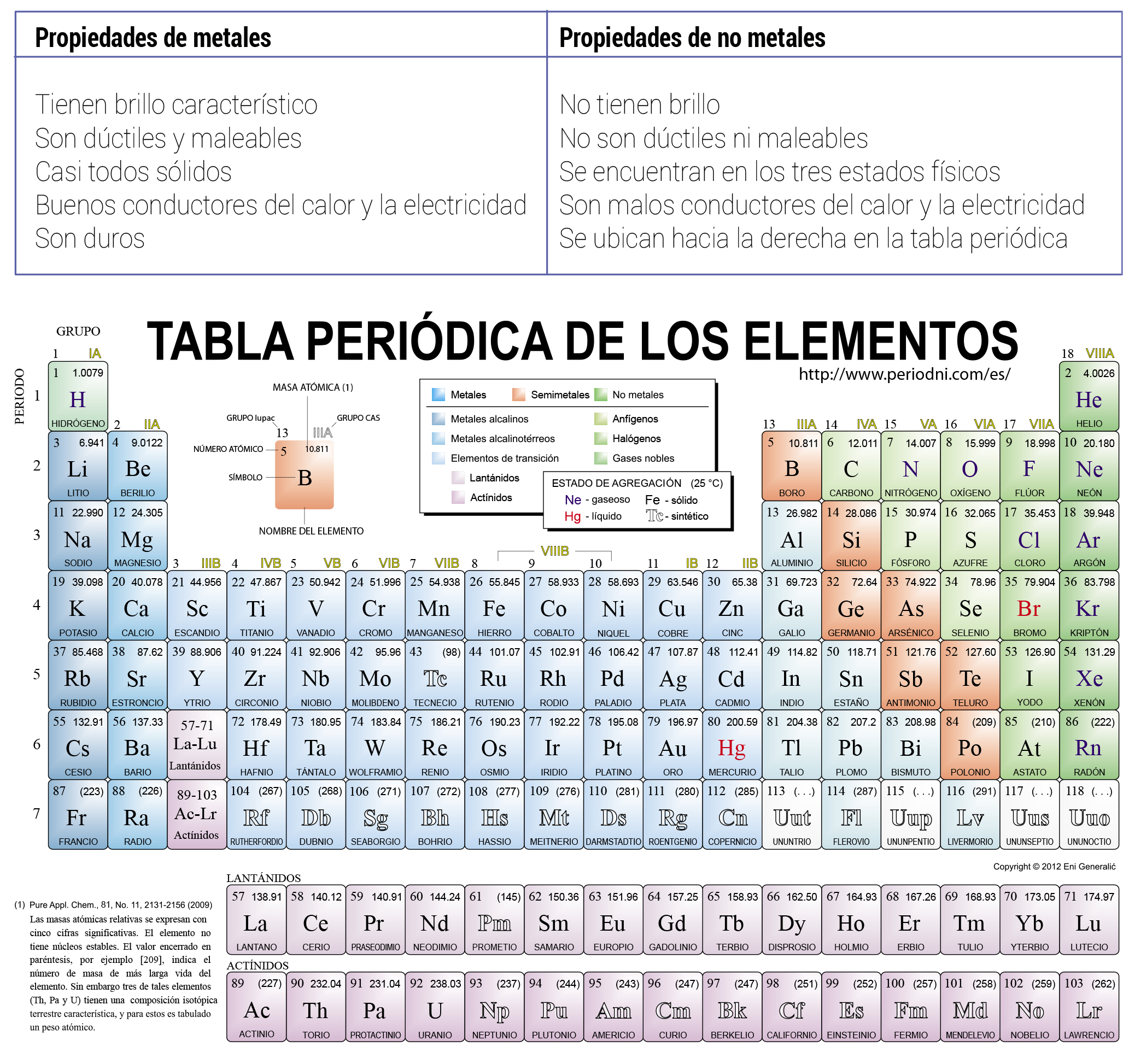
Para estudiar los elementos químicos hasta ahora descubiertos Mendeléyev ideó este patrón en tabla. El grupo 4 de la tabla periódica lo comprenden los elementos titanio Ti circonio Zr y hafnio Hf así como el elemento rutherfordio Rf aunque no se suele tener en cuenta al referirse al grupo 4 pues se trata de un elemento sintético y radiactivo. Es un elemento semimetálico del grupo de los elementos de transición de color blanco plateado frágil que se encuentra en estado puro o combinado con oro plata cobre plomo y níquel en algunos minerales.
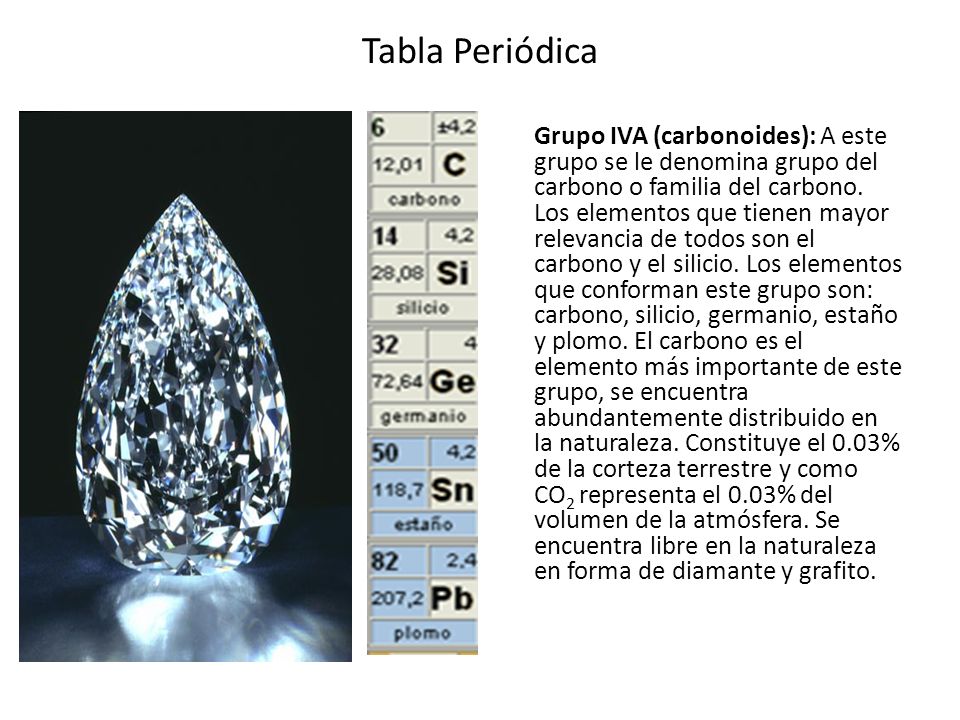
GRUPO 4A Los elementos que componen a la familia del carbono o carbonoides son. HALOGENOS Los halógenos del griegoformadorde salessonlos elementos químicos que forman el grupo 17 XVII A utilizado anteriormente o grupo VII A de la tabla periódicaflúor F cloro Cl bromo Br yodo I astato At y téneso Ts. Las valencias químicas normales son 2 y 4.
Los elementos del grupo IVA son. Forman másde la cuarta parte de la masa de la corteza terrestre especialmente por el silicio segundo elemento más abundante tras el oxígeno. 61 Propiedades de los elementos De todos los grupos de la tabla periódica el grupo IVA es el que muestra la mayor discontinuidad entre las propiedades de los elementos del segundo y tercer períodos seguido de un cambio relativamente suave hacia el carácter metálico.
Todos los elementos de este grupo poseen el número de oxidación 3 exceptuando al galio indio y talio que tienen el grado de oxidación 1 pero el predomínate en galio e indio. Se usa en la fabricación de dispositivos rectificadores y termoeléctricos en la investigación de semiconductores para. Los elementos de este grupo presenta diferentes estados de oxidación y estos son.
Es relativamente resistente al ataque del ácido sulfúrico y del ácido clorhídrico aunque se disuelve con lentitud en ácido nítrico y ante la presencia de bases nitrogenadas. Su principal mena es la casiterita. Todos tienen números de oxidación 2 y 4 sin embargo en el carbono y el silicio predominan los compuestos de número de oxidación 4 CO2 y SiO2 y en el.
Gerardojesuslol1650 gerardojesuslol1650 13112017 Química Universidad contestada Caracteristicas del grupo 2a de la tabla periodica. Usos y aplicaciones de los elementos del grupo 4. La tabla periódica de los elementosDentro de la tabla periódica aparecen filas horizontales y columnas verticales.
2 y 4 los compuestos orgánicos presentan variedad en su oxidación Mientras que los óxidos de carbono y silicio son ácidos los del estaño y plomo son anfótero el plomo es un elemento tóxico. Su fusión se produce a 3274 C y hierve a 1725 C. Está situado en el grupo 14 de la tabla periódica de los elementos.
Carbono C Silicio Si Germanio Ge Estaño Sn Plomo Pb El carbono es un no metal es uno de los elementos mas significativos de la tabla periódica porque integra una gran cantidad de compuestos y entre ellos a las sustancias que forman a los seres vivos. Carbono silicio germanio estaño y plomo. Se conocen 10 isótopos estables.
1 Ver respuesta gerardojesuslol1650 está esperando tu ayuda. Añade tu respuesta y gana puntos. El carbono constituyente fundamental de la materia orgánica es elsegundo elemento del grupo en abundancia.
Caracteristicas del grupo 2a de la tabla periodica. Estaño El estaño es un elemento químico de símbolo Sn del latín stannum y número atómico 50. Es flexible inelástico y se funde con facilidad.
Carbono C silicio si germanio ge estaño Snplomo Pb erristeneo Eo. El carbono y sus compuestos se encuentran distribuidos ampliamente en la naturaleza. Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros su configuración electrónica termina en ns2p2.
Este último también está en los metales del bloque f.