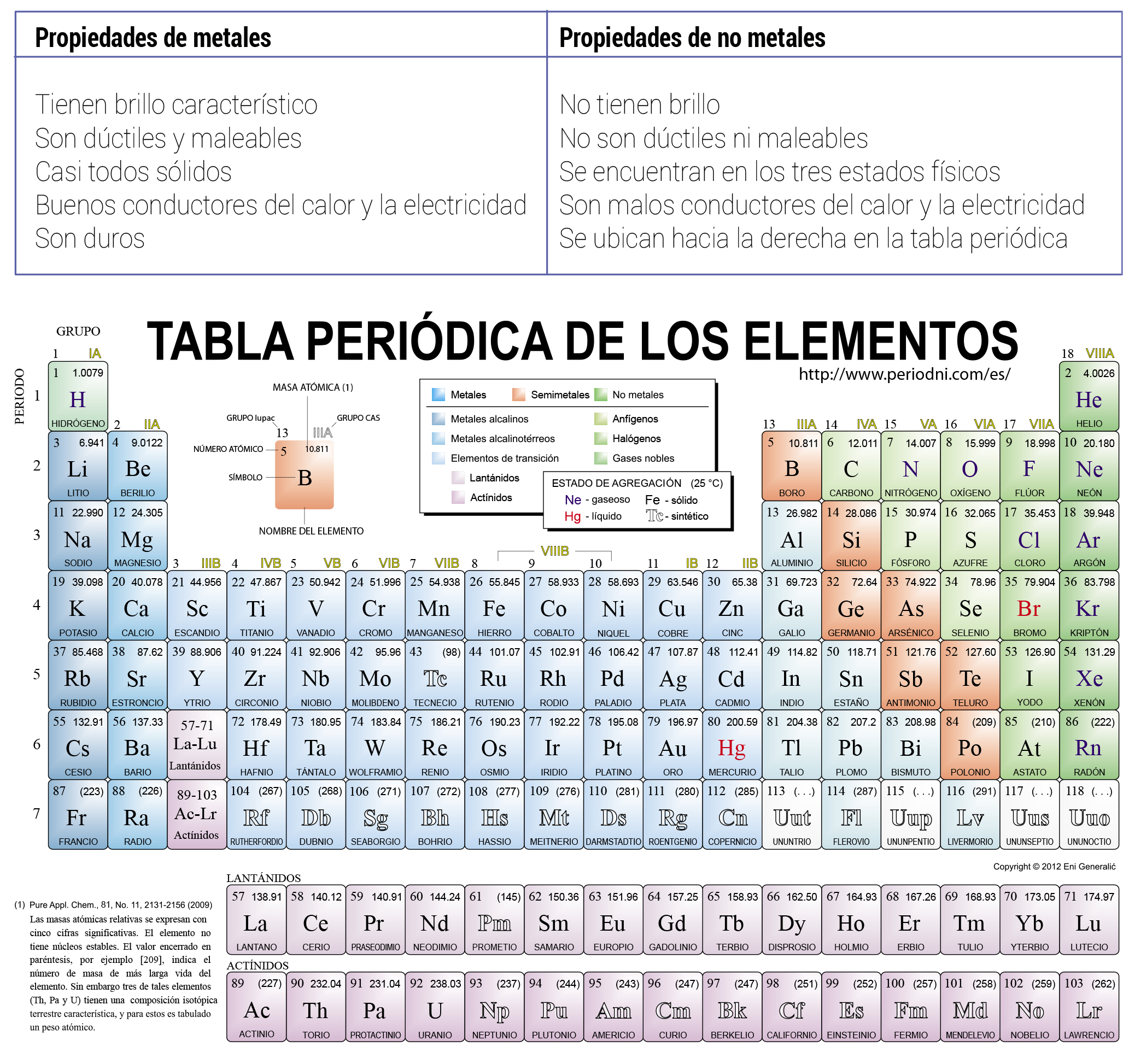
Propiedades Del Grupo 6a De La Tabla Periodica
Se sitúan en el grupo 18 VIIIA de la tabla periódica anteriormente llamado grupo 0.
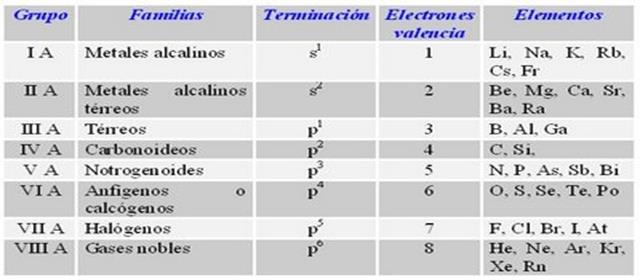
Propiedades del grupo 6a de la tabla periodica. Los grupos o familias de elementos vienen agrupados en columnas en la Tabla Periódica porque gozan de propiedades parecidas. El dióxido de carbono se utiliza para carbonatación de bebidas en extintores de fuego y como enfriador hielo seco en estado sólido. Sus miembros son el cromo Cr molibdeno Mo wolframio W y seaborgio Sg.
Tiene como Valencia 2. La tabla periódica es una ordenación de los elementos químicos en disposición creciente del número atómico Z que pone de relieve la periodicidad del comportamiento químico es decir que pasando un determinado número de elementos se vuelve a encontrar un elemento con propiedades químicas semejantes. Grupo 6a de la tabla periodica OXIGENO El oxígeno es un elemento químico de número atómico 8 y representado por el símbolo O.
Por ejemplo bajo condiciones normales son gases monoatómicos inodoros incoloros y presentan una reactividad química muy baja. El oxígeno es un agente oxidante fuerte pero existe una marcada disminución del poder oxidante al bajar en el grupo. GRUPO 6A Grupo del Oxigeno El grupo VIA del sistema Periódico o grupo del oxígeno está formado por los elementos.
Tienden a perder electrones. Propiedades físicas Las propiedades físicas de este grupo varían mucho en cada elemento y el carácter metálico aumenta del selenio al polonio. Estos metales de transición presentan 6 electrones de valencia.
Por la pérdida de los dos electrones de valencia ns 2 todos ellos forman la especie M2 que es la característica de. Los potenciales de reducción que aparecen en la Tabla 41 dan una idea del poder oxidante de los elementos del grupo VIA. Cromo Cr Molibdeno Mo Wolframio o Tungsteno W y Seaborgio Sg.
El tetracloruro de carbono y el disulfuro de carbono se usan como disolventes industriales importantes. 2 electrones s de la última capa y 4 electrones d de la penúltima. El monóxido de carbono se emplea como agente reductor en procesos metalúrgicos.
Propiedades fisicas y quimicas de los grupos de la tabla periodica. USOS Todos los elementos del grupo. Se requiere una gran cantidad de energía para romper estos enlaces durante la fusión o la vaporización por lo que el carbono tiene los puntos de fusión y de ebullición más altos de todo el grupo.
Elementos químicos configuración electrónica formulación estados de oxidación. Tienen baja energía de ionización. El miembro más pesado del grupo el plo- Tabla 61 Propiedades de los elementos del grupo IVA.
A causa de esta fotoconductividad el selenio se a utilizado en los medidores de luz para cámaras fotográficas y en fotocopiadoras pero la preocupación que origina su toxicidad ha hecho que disminuya su uso. La conductividad de este elemento aumenta con la intensidad de la luz. Su solubilidad es bastante baja.
El selenio es un no metal que presenta interesantes propiedades y usos. El freón se utilizaba en aparatos de refrigeración hecho que está desapareciendo debido a lo dañino de este compuesto para la capa de. En este grupo se encuentran el magenio calcio berilio estroncio bario y radio.
Por encontrarse en el extremo derecho de la Tabla Periódica es fundamentalmente no-metálico. De hecho el H 2Te y el H 2Se son mejores reductores que el hidrógeno. Oxígeno azufre selenio telurio polonio.
Los elementos metálicos del grupo el estaño y el plomo no reaccionan con el agua pero sí con los ácidos como el clorhídrico HCl liberando hidrógeno. El grupo 6 está conformado por. Todos ellos son metales de transición y el cromo el molibdeno y el.
El selenio también puede. PROPIEDADES FARMACOLOGICAS Es un regulador y normalizador del metabolismo y división celular es un protector metabólico evita la destrucción de las macromoléculas del tejido conjuntivo estimula y regula las mitosis celulares de los fibroblastos normaliza el metabolismo celular. Aunque el carácter metálico aumenta al descender en el grupo.
El grupo 2a son los metales alcalinoterreos. Su nombre proviene de las raíces griegas ὀξύς oxys ácido literalmente punzante en referencia al sabor de los ácidos y γόνος -gonos. Los elementos del grupo 6 numerado así por el estilo IUPAC antes se empleaba grupo VIA en el sistema europeo y grupo VIB en el estadounidense es un grupo de elementos en la tabla periódica.
Son metales de baja densidad. El oxígeno en ambientes estándar de presión y temperatura se encuentra formando el dioxígeno un gas diatómico incoloro inodoro e insípido.