Elementos Menos Reactivos De La Tabla Periodica
Los metales menos reactivos son los conocidos como metales nobles muy apreciados en joyería especialmente el platino y el oro.
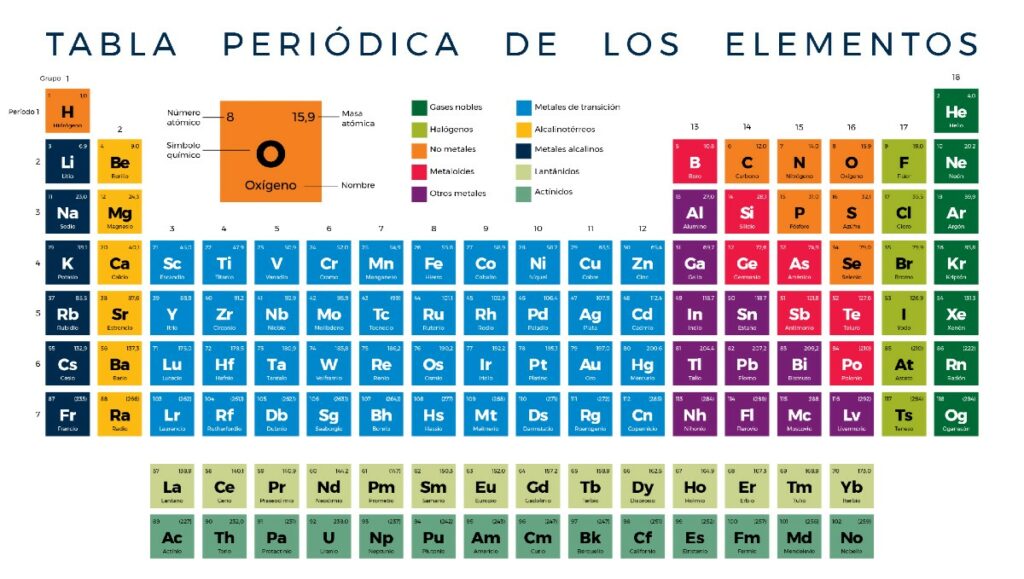
Elementos menos reactivos de la tabla periodica. Y por último los gases nobles elementos muy estables se encuentran en. Por lo tanto dicha capa está completa y son poco reactivos. Sus densidades son bajas pero son algo mas elevadas que la de los metales alcalinos.
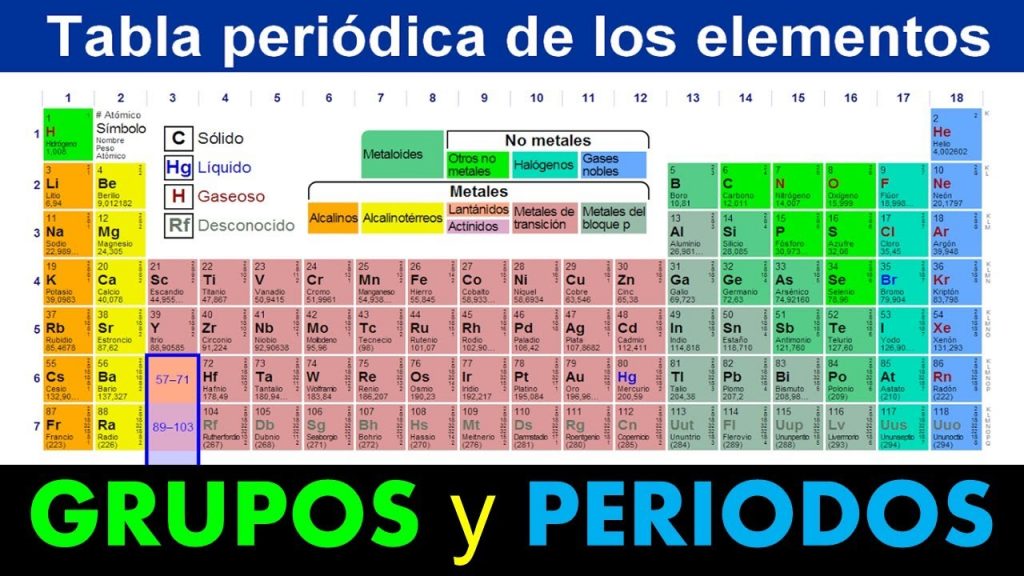
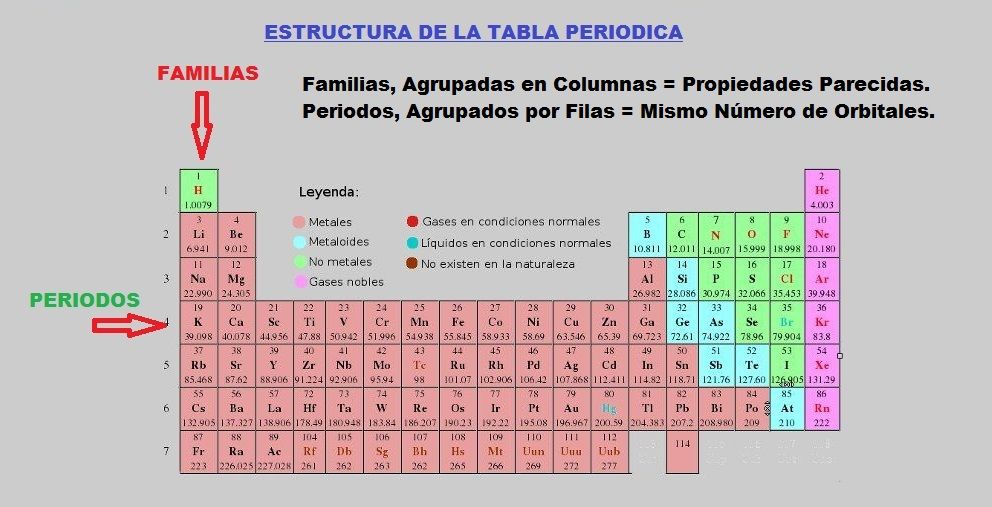
Son menos reactivos que los metales alcalinos. A He Ne Ar y Xe b C H O N y P c B Si Ge y Ar d Ac U Np y P 13 Del Rutherfodio Rf hasta el Organesson Og son considerados los de mayor número atómico Z 104 - 118 radiactivos ubicados en el periodo 7 a Metales b Elementos superpesados c Elementos. Los no metales se encuentran en la parte superior derecha de la tabla periódica.
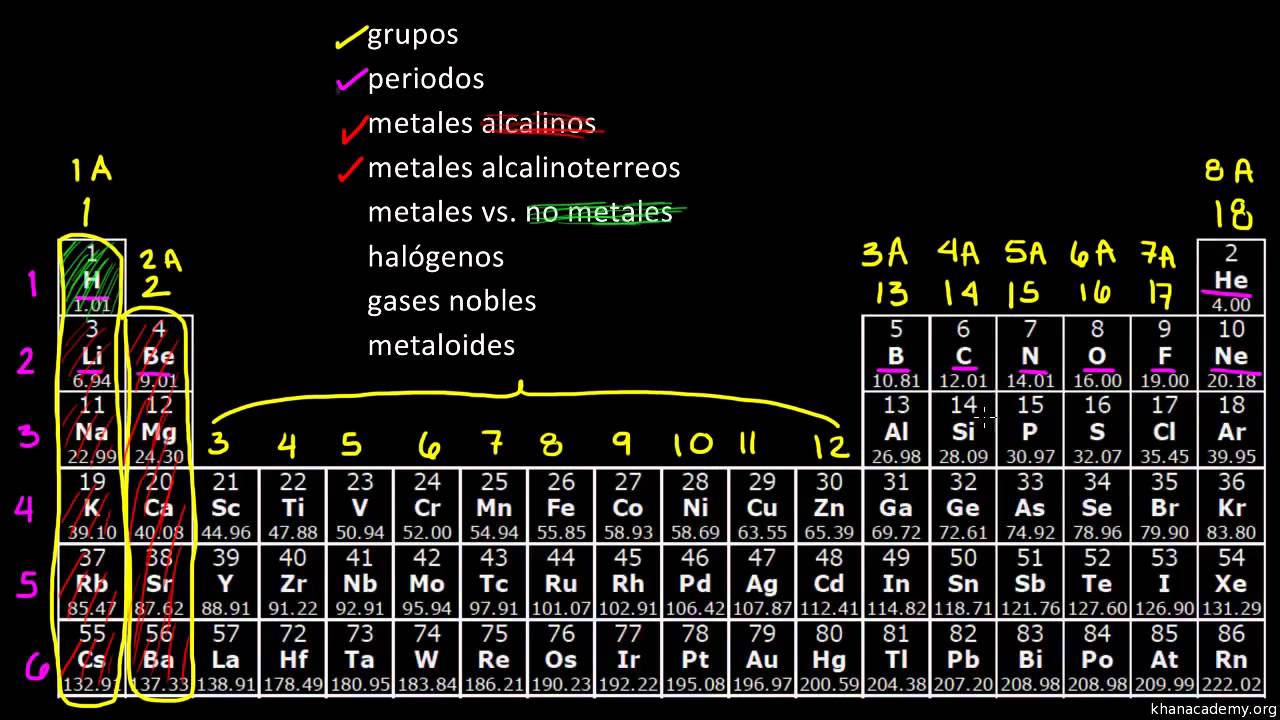
C con la invención del espectroscopio se descubrieron nuevos elementos muchos de ellos nombrados por el color de sus líneas espectrales características. Las propiedades únicas del hidrógeno lo apartan del resto de los elementos en. Metales Alcalinotérreos Se les llama alcalinotérreos a causa del aspecto térreo de sus óxidos Sus densidades son bajas pero son algo mas elevadas que la de los metales alcalinos Son menos reactivos que los metales alcalinos No existen en estado natural por ser demasiado activos y generalmente se presentan formando silicatos carbonatos cloruros y sulfatos 2 IIA.
Esto se debe a que es el elemento con mayor electronegatividad es decir atrae los electrones de otros átomos hacia sí mismo con elevada intensidad. Posteriormente a mediados del siglo XIX d. Lo que hace que reacciones más fuerte y rápidamente que otros elementos.
Los metales alcalinos también son muy reactivos por su baja electronegatividad. El resto de los no metales pertenecen a diversos grupos y son hidrógeno carbono azufre selenio nitrógeno oxígeno y fósforo. Metales alcalinotérreos Se les llama alcalinotérreos a causa del aspecto térreo de sus óxidos.
Por su parte el cromo el hierro el estaño o el cobre son aún menos reactivos y solo reaccionan con ácidos fuertes y son a menudo utilizados para fabricar estructuras en construcción. Los metales alcalino-térreos más comunes son el magnesio y. Precisamente la cualidad de ser poco reactivos es una de las características que ha hecho que sean muy apreciados desde la antigüedad ya que el instrumento o adorno hecho con ese metal no se deterioraba.
C la investigación en los procesos radioactivos llevó al descubrimiento en cascada de una serie de elementos. Los halógenos son elementos no metálicos muy reactivos y se encuentran en el grupo 17. Elementos enumerados arriba en el grupo de elementos.
Por lo tanto con solo mirar la tabla periódica puede predecir que el litio será menos reactivo que el sodio y el francio será más reactivo que el cesio y todos los demás. Los elementos tienden a volverse menos reactivos a medida que se aproxima a la mitad y luego comienzan a volverse más reactivos hasta llegar a los gases nobles. No existen en estado natural por ser demasiado activos y generalmente se presentan formando silicatos carbonatos cloruros y sulfatos.
El flúor es el elemento más reactivo de la tabla periódica. Son menos reactivos que los metales alcalinos. Cesio Cs del latín caesĭus azul talio Tl de tallo por su color verde rubidio Rb rojo etc.
Algunos ejemplos son el Magnesio Mg Calcio Ca Estroncio Sr y el Bario Ba. Estos son los elementos en el extremo derecho de la tabla helio neón argón criptón xenón y radón. Berilio Magnesio Calcio Estroncio Bario Radio Be Mg Ca Sr Ba Ra.
Estos metales berilio magnesio calcio estroncio bario y radio componen la familia 2 de la Tabla Periódica. Los menos activos son los metales alcalinotérreos. Se encuentran en la naturaleza formando sales con los no metales.
Acomodan hasta 32 electrones en sus capas de valencia. Son también reactivos pero menos que los de la familia 1. Durante el siglo XX d.
A Metales b Gases nobles c Lantánidos y actínidos d Halógenos 12 Elementos radiactivos de la familia de los actínidos z 89 - 103.