Caracteristicas Del Grupo B De La Tabla Periodica
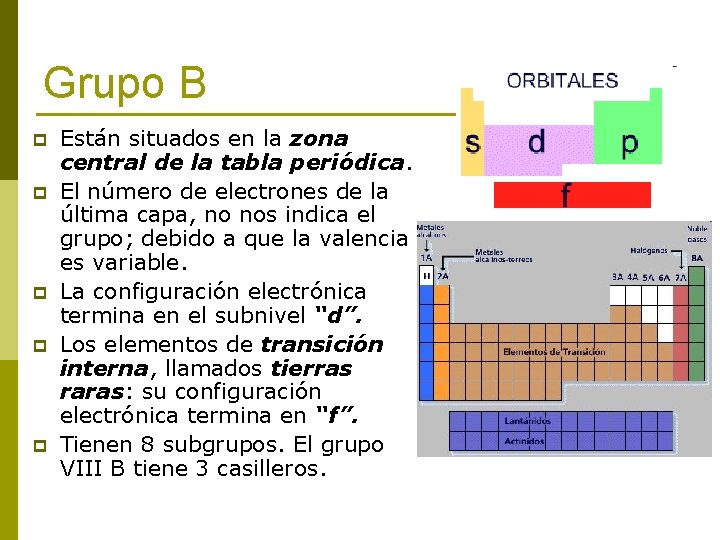
Está dividido en tres subgrupos de tres elementos cada uno conociéndoselo como Fe-Co-Ni por estar encabezados por el Hierro el Cobalto y el Níquel respectivamente.
Caracteristicas del grupo b de la tabla periodica. Hierro Rutenio y OsmioTodos tienen ocho electrones activos en sus últimas capasEl Hierro y el Osmio tienen 2 en subcapa s en. En las químicas forman cationes al perder electrones. Todos son considerados comoelementos de transición.
Poseen una mayor electronegatividad y energía de ionización que los elementos del grupo anterior. Los elementos del grupo B sus electrones de valencia se encuentran distribuidos en órbitas diferentes a las del grupo A. El primer elemento del grupo 13 es el boro B aunque también se lo conoce como grupo del aluminio por su concurrido uso en la actualidad un metaloide con un punto de fusión muy elevado y en el que predominan las propiedades no metálicas.
Grupo 2 B Tienen configuración electrónica y tienen. Es un Metal de transición de color blanco grisáceo duro y muy frágil es parecido al hierro es refractario y fácilmente oxidable. Su color va desde gris al blanco.
El Hierro la Plata el Cobre y el Oro son elementos de transición que presentan características diferentes de los demás elementos que conforman la familia. En cambio poseen menor radio atómico. Esto se debe a que todos los electrones de los niveles 3d y 4s los utilizan para formar enlaces químicos.
Argentum blanco o brillante. Con tres electrones de valencia 2 electrones s de la última capa y 1 electrón d de la capa penúltima se parecen a los del grupo 13 aunque son menos nobles carácter que disminuye al aumentar el número atómico. El manganeso es uno de los elementos químico de la tabla periódica que lleva el numero atómico 25 situado en el séptimo periodo su símbolo se escribe Mn.
Escandio itrio lantano y lantánidos actinio y actínidos. A excepción del berilio forman compuestos. Pueden formar aleaciones entre ellos.
Mayor que los alcalinos del mismo período tanto menor si se desciende en el grupo. Todos son considerados como elementos de transiciónPrimer subgrupo. Muy buenos conductores tanto del calor como de la electricidad.
Cuantos más electrones compartan un núcleo más fuerte es el metal. Su símbolo es Ag procede del latín. La tabla periódica esta agrupada por grupos y periodos que estos indican que mantienen cierta similitud en cuanto a sus propiedades químicas por el hecho de que tienen el mismo número de electrones de valencia.
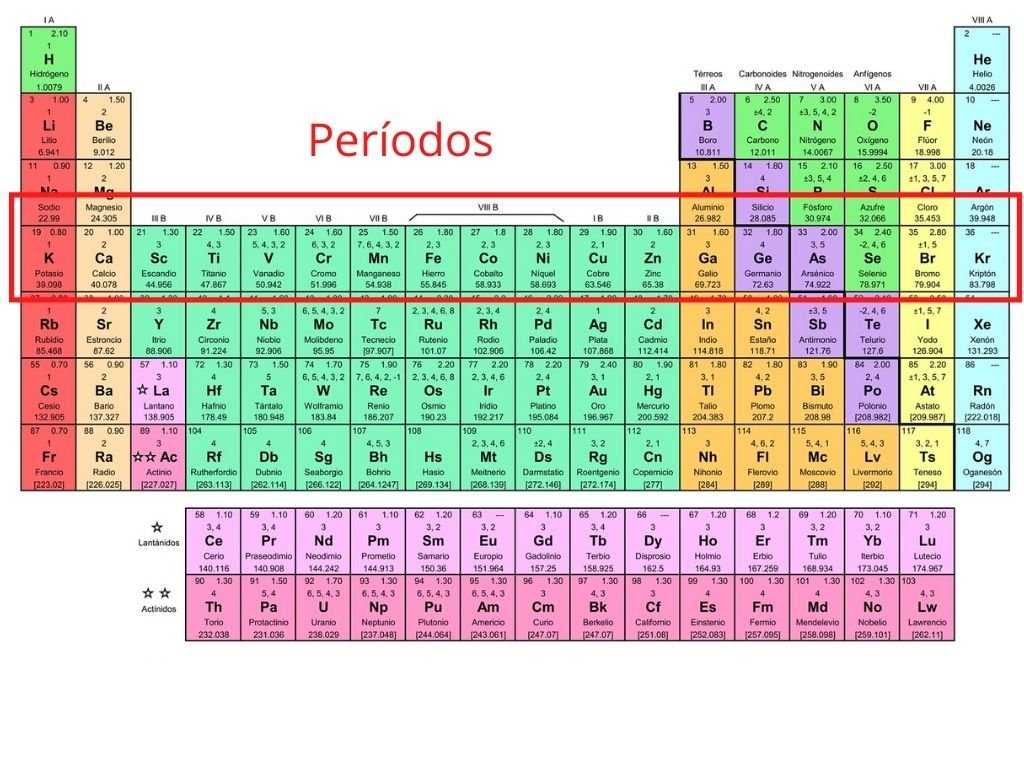
Mencionar las propiedadesver más. Masa atómica g mol. Mientras que los grupos 3 4 5 6 7 8 9 10 11 y 12 pertenecen al grupo B o metales de transición.
Características de la tabla periódica Su breve historia. Son en general buenos catalizadores. La mayoría de estos elementos químicos pueden encontrarse en la naturaleza ya sean puros o en mezclas con otros compuestos o elementos.
La plata es un elementoLa Plata químico de número atómico 47 situado en el grupo 1b de la tabla periódica de los elementos. Compuesto por los elementos boro B aluminio Al galio Ga indio In talio Tl y nihonio Nh también son llamados térreos dado que son muy abundantes en la corteza terrestre a excepción del último de la lista sintético e inexistente en la naturaleza. Es un metal de transición blanco brillante blando dúctil maleable.
Está dividido en tres subgruposde tres elementoscada uno conociéndoselo como Fe-Co-Ni por estar encabezados por el Hierro el Cobalto y el Níquel respectivamente. Primer subgrupoHierro Rutenio y Osmio. Los grupos o columnas verticales de la tabla periódica fueron clasificados tradicionalmente de izquierda a derecha utilizando números romanos seguidos de las letras A o B en donde la B se refiere a los elementos de transición.
La clasificación de los elementos fue iniciada por Dmitri Mendeléyev en el 1869 desarrollada en ese momento con el objetivo de ilustrar los elementos conocidos exponiendolos de la manera más adecuada y sencilla posible para mostrar sobre todo las tendencias periódicas de estos elementos y ordenarlos según las propiedades. Los elementos del grupo B presentan varios estados de oxidación.