A Z Tabla Periodica
Tabla periódica exámen 1 y soluciones de problemas.
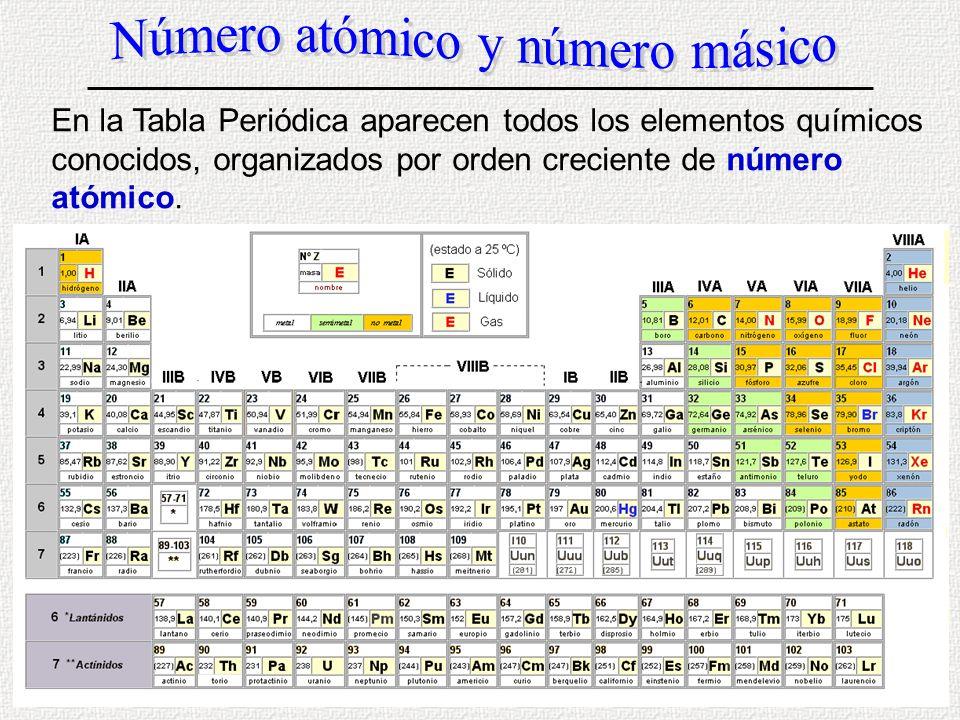
A z tabla periodica. N Z A. D N Z A 2Z. 92 U Uranio 23803.
Se suele representar con la letra Z. 09 11011111211311411511 11 predicciones 61 93 15036 Sm Xe 244 sat 7 pu Rn 62 94 15725 L 4fSd1. La tabla moderna de los elementos se basa en las observaciones de Mendeleyev.
X Y y Z son en el mismo período. Número de neutrones más el número atómico es igual al número de masa atómica. 91 Pa Protactinio 23104.
Corresponde a los elementos situados a la izquierda y centro de la Tabla Periódica Grupos 1 excepto hidrógeno al 12 y en los siguientes se sigue una línea quebrada que aproximadamente pasa por encima de Aluminio Grupo 13 Germanio Grupo 14 Antimonio Grupo 15 y Polonio Grupo 16 de forma que al descender aumenta en estos grupos el carácter metálico. Entrá y conocé nuestras increíbles ofertas y promociones. Formado por los elementos representativos llamados así porque sus propiedades varían de manera muy regular.
La diferencia entre el número de neutrones y el número atómico se conoce como exceso de neutrones. Z 96 485 eV Todos os elementos tienen un estado de oxidación implícito cero osestadosde oxidación de Ios elementos 109 7 y 8 son predicciones 11111211311411511 11 Las configuraciones electronicas de Ios elementos 105. Z Analizar e interpretar la variación de las propie-dades a través del grupo y del periodo.
En 1813 el sueco Jacob Berzelius realizó la primera clasificación de los elementos primer intento y los dividió en me-. Aplicando la regla de las diagonales escribir la configuración electrónica de los elementos que se indican a continuación. La tabla periódica moderna cuenta con 18 elementos que se ordenan por un número atómico Z Creciente y se organizan en 7 filas o periodos y 18 columnas Tabla periódica a través de la historia.
Z -2 número igual de electrones y los X - tienen. Número atómico Z y Masa atómica A El número atómico es el número total de protones en el núcleo del átomo. Sin embargo en vez de estar organizada por el peso átomico la tabla moderna está organizada por el número átomico z.
89 Ac Actinio 227 90 Th Torio 23204. 93 Np Neptunio 237 94 Pu Plutonio 244 95 Am Americio 243. A Período y grupo al que pertenecen.
Además de esto los elementos aparecen distribuidos en filas y columnas. A medida que se va de izquierda a derecha en una hilera de la tabla periódica las propiedades de los elementos cambian gradualmente. OBJETIVOS HISTORIA A principios del siglo XIX el número de elementos conocidos se duplicó de 31 en 1800 a 63 hacia 1865.
Para los elementos estables suele haber una variedad de isótopos estables. Usando la información dada a continuación encontrar propiedades metálicas de la relación entre ellos. Z Ubicar cualquier elemento en la tabla periódica conociendo su número atómico.
Según el orden creciente de su número atómico Z en lugar de su masa atómica dando lugar a la tabla periódica actual o sistema periódico En ella los elementos se encuentran ordenados de izquierda a derecha por valores crecientes de sus números atómicos Z. Descubrí la mejor forma de comprar online. Z Sintetiza al conocimiento de los elementos facili-tando su aprendizaje.
9 de protones y de neutrones. La tabla periódica es una forma de clasificar los elementos químicos en función de alguna característica o propiedad Z Antecedentes históricos A principios del siglo XIX existían cerca de 33 elementos descubiertos. Los átomos de diferentes elementos tienen.
La ubicación de los elementos químicos en la tabla periódica tiene como base en su número atómico Z IMPORTANCIA Z Predicción con bastante exactitud de las propie-dades de cualquier elemento. Los elementos pertenecientes a los grupos A poseen electrones de valencia en los orbitales yo. Para los siguientes elementos.
Están situados en los extremos de la tabla periódica. Actualmente la tabla periódica se compone de 118 elementos distribuidos en 7 filas horizontales llamadas periodos y 18 columnas verticales conocidas como gruposSu descubridor el químico ruso Dmitri Mendeléiev no fue premiado con el Nobel por lo que es una de las contribuciones capitales en la historia de la química. Se explica cómo aprender más sobre la tabla periódica y los elementos de los grupos A.